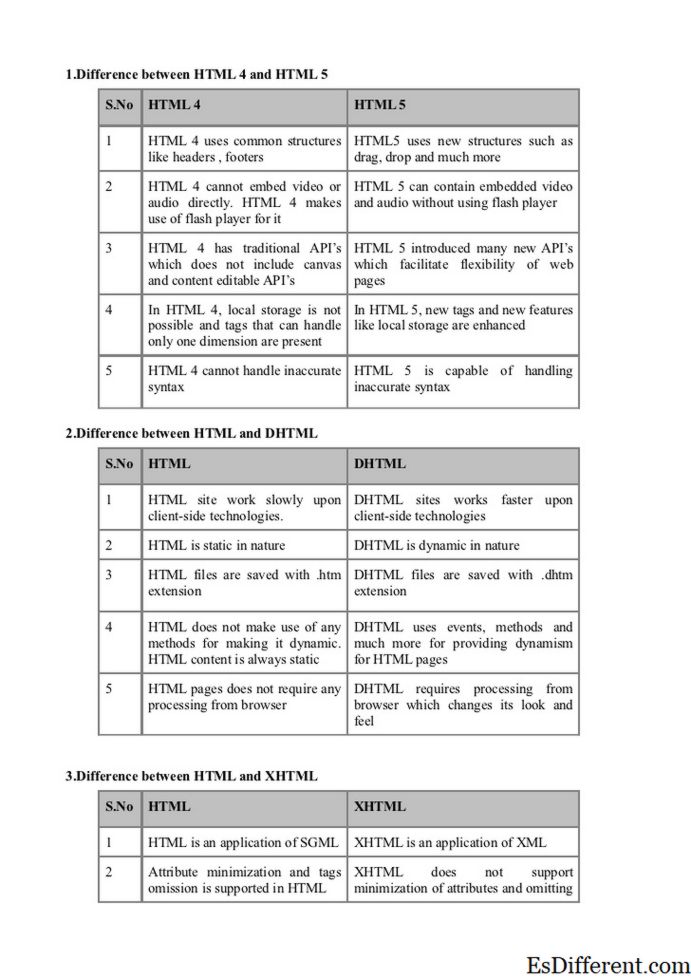
Erot isotonisen liuoksen ja tasapainon välillä
Erot isotonisen liuoksen ja tasapainon välillä
Sekä isotoninen että tasapaino jakavat saman määritelmän; molemmilla on merkitys "tasapaino" tai "tasa-arvo" - mutta lopulta heillä on vielä eroja. Isotoninen liuos on kahden tai useamman aineen seos; aineet, joilla on sama suolapitoisuus kuin verisoluja ympäröivät - kun taas tasapaino on ratkaisun tila sinänsä.
Kemian tapauksessa isotooninen liuos on olemassa, kun soluissa ja sen ulkopuolella on samanlainen liukeneva pitoisuus. Verrattuna näihin asioihin nähden isotoonisella liuoksella on siinä samassa määrin liuotettua liukenematonta ainetta - mikä yksinkertaisella tavalla tarkoittaa sitä, että se on samanlainen ratkaisu. Toisaalta kemiallisessa tasapainossa viitataan tilaan, jossa liuoksen sanotaan olevan kyllästetty. Tällainen kyllästysprosessi tapahtuu vain silloin, kun liukenemis- ja saostumisnopeudet ovat yhtä suuret toistensa kanssa - tasapaino saavuttaa pohjimmiltaan tasaisen pitoisuuden tilan.
Isotoninen liuos
Isotonisessa liuoksessa molekyylit virtaavat sisäänpäin ja ulospäin yhtä suurella nopeudella osmoosin avulla, mikä saa solukoko pysyvän samana - ne eivät menettä tai hanki mitään liukenevia. Esimerkki isotoonisesta liuoksesta on, kun sekoitat natriumkloridia (suolaa) ja tislattua vettä - tämä johtaa siihen, mitä kutsutaan suolaliuokseksi. Tavallisesti saatavilla on useita pitoisuuksia, ja sitä käytetään yleisesti lääketieteellisiin tarkoituksiin, ja sitä esiintyy suonensisäisissä tai IV: n tippuvuissa, piilolinsseissä ja nenäsuihkutussuihkeissa. Usein sitä käytetään kemian kokeisiin, koska ne on suunniteltu vastaamaan henkilön solunsisäistä nestettä, koska ne ovat samanlaisia osmoottisissa paineissa henkilön solujen sisällä ja ulkopuolella. Se estää nesteen siirtymisen, mikä on erittäin hyödyllistä lääketieteellisiin tarkoituksiin.
tasapaino
Kun tasapaino tapahtuu, kemiallinen reaktio ja sen käänteisreaktio tapahtuvat yhtä suurilla nopeuksilla - silloin kun kaikki vaikuttavat vaikutukset kumoutuvat toisilla, jotka johtavat vakaan, tasapainoisen ja muuttumattoman järjestelmän aikaansaamiseen. Sisään- ja ulosporeaktionopeudet eivät yleensä ole nollia, mutta yhtä suuret. Pohjimmiltaan tasapainossa mikään ei muutu eikä mitään liikkua. Tällaista tilaa kutsutaan dynaamiseksi tasapainoksi. Esimerkki dynaamisesta tasapainosta on, kun henkilö polttaa paperia (selluloosaa). Reaktio jatkuu, kunnes jompikumpi reagensseista loppuu; vain silloin pysähtyy. Käännettävät reaktiot ovat periaatteessa yksinkertaisia yksivaiheisia reaktioita molempiin suuntiin.
Ainoa ero isotonisen liuoksen ja tasapainon välillä on se, että isotoninen liuos tarkoittaa, että kaikki liuoksen sisältämä sisältö on tasaisesti tasapainossa, mutta tasapainossa on liikkeitä, kaikki liuoksen sisältämä sisältö tasapainotetaan tasaisesti, mutta ei liikuja lähinnä siksi, että muut toimivat vaikutteet kumoavat - siksi tasapainossa on vakautta.
Yhteenveto:
-
Isotoninen liuos on kahden tai useamman aineen seos; aineet, joilla on sama suolapitoisuus kuin verisoluja ympäröivät - kun taas tasapaino on ratkaisun tila sinänsä.
-
Isotonisessa liuoksessa molekyylit virtaavat sisäänpäin ja ulospäin yhtä suurella nopeudella osmoosin avulla, mikä saa solukoko pysyvän samana - ne eivät menettä tai hanki mitään liukenevia.
-
Kun tasapaino ilmenee, kemiallinen reaktio ja sen käänteisreaktio tapahtuvat yhtä suurilla nopeuksilla - silloin kun kaikki vaikuttavat vaikutukset kumoavat toiset, jotka johtavat vakaan, tasapainoisen ja muuttumattoman järjestelmän aikaansaamiseen.
-
Ainoa ero isotonisen liuoksen ja tasapainon välillä on se, että isotoninen liuos tarkoittaa, että kaikki liuoksen sisältämä sisältö on tasaisesti tasapainossa, mutta tasapainossa on liikkeitä, kaikki liuoksen sisältämä sisältö tasapainotetaan tasaisesti, mutta ei liikuja.